Vamos a recordar lo que es un Grupo amino y un grupo carboxilo antes de empezar con el tema. 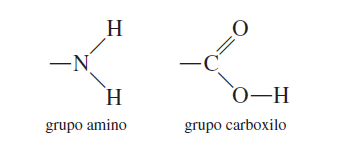 Los α-aminoácidos son un grupo heterogéneo de moléculas que poseen unas características estructurales y funcionales comunes. Existen 20 aminoácidos diferentes especificados en el código genético, aunque hay otros aminoácidos menos frecuentes que se forman por modificaciones enzimáticas posteriores al proceso de traducción. En las células, estos 20 aminoácidos se unen mediante enlaces covalentes formando largas cadenas de combinaciones específicas que producen un gran número de proteínas diferentes. La posición lineal concreta de los aminoácidos de una proteína constituye su secuencia primaria y es esta secuencia la que va a determinar su estructura tridimensional específica que es fundamental para que desempeñe su función.
Los α-aminoácidos son un grupo heterogéneo de moléculas que poseen unas características estructurales y funcionales comunes. Existen 20 aminoácidos diferentes especificados en el código genético, aunque hay otros aminoácidos menos frecuentes que se forman por modificaciones enzimáticas posteriores al proceso de traducción. En las células, estos 20 aminoácidos se unen mediante enlaces covalentes formando largas cadenas de combinaciones específicas que producen un gran número de proteínas diferentes. La posición lineal concreta de los aminoácidos de una proteína constituye su secuencia primaria y es esta secuencia la que va a determinar su estructura tridimensional específica que es fundamental para que desempeñe su función.
- Si una cadena está formada de 2 a 50 α-aminoácidos diremos que tenemos un péptido.
- Si una cadena está formada por más de 50 α-aminoácidos diremos que tenemos una proteína.
- Son los más frecuentes y de mayor interés.
- Forman parte de las proteínas.
- Están formados por un carbono α unido a:
- Un grupo Carboxilo
- Un grupo Amino
- Hidrógeno
- Cadena lateral (R)
- La cadena lateral determina la identidad y las propiedades de los diferentes aminoácidos.
Tenemos 20 α-aminoácidos y se nombran con abreviaturas de 3 letras o 1 letra, nosotros vamos a gastar las de 3 letras. 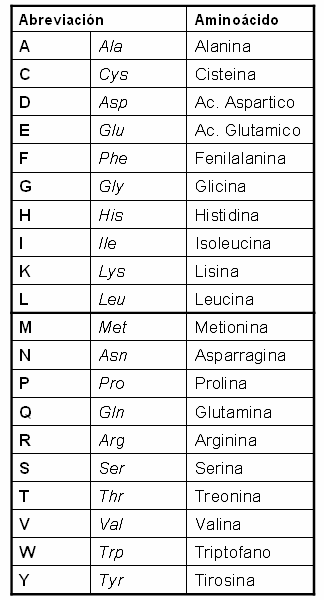 Tenemos que tener especial cuidado con la Glutamina (Gln) y el Glutamato o ácido glutámico (Glu) ya que al escribirlo en un exámen podemos no diferenciarlos por la caligrafía.
Tenemos que tener especial cuidado con la Glutamina (Gln) y el Glutamato o ácido glutámico (Glu) ya que al escribirlo en un exámen podemos no diferenciarlos por la caligrafía.
- Excepto en la Gly(Glicina), el Carbono α tiene 4 substituyentes distintos, por lo que es un centro quiral. Así, los aminoácidos se pueden presentar orientados en el espacio de dos formas diferentes que son imágenes especulares no superponibles denominados enantiómeros.
- Siguiendo la representación de Fischer, propuesta para los azúcares, los enantiómeros se designan con las letras D o L, según su analogía con el D o L-gliceraldehído.
- Los aminoácidos que forman las proteínas sólo pertenecen a las formas del enantiómero L, aunque se desconoce el motivo por el que se ha elegido esta forma durante la evolución.
- Como excepción, existen formas D en algunos péptidos que forman parte de la composición de las paredes bacterianas. Estas formas D se forman a partir de las L por la actuación de una enzima (racemasa) que es frecuente objetivo farmacológico antibacteriano.
- Además del Carbono α, algunos aminoácidos presentan carbonos asimétricos en su cadena lateral, como es el caso de la Tyr y la Ile.
PROPIEDADES ÓPTICAS DE LOS AMINOÁCIDOS Los aminoácidos poseen actividad óptica y sus disoluciones desvían el plano de la luz polarizada.
- Hacia la derecha (en sentido horario): dextrógiro
- Hacia la izquierda (sentido antihorario): levógiro
La configuración D o L no implica que un enantiómero sea dextrógiro o levógiro.
PÉPTIDOS: CONCEPTO, NOMENCLATURA Y PROPIEDADES
Los péptidos están formados por la unión de dos o más aminoácidos mediante enlaces peptídicos.
- Si se unen desde 2 a 50 aminoácidos es un péptido.
- Si se unen más de 50 aminoácidos es ya una proteína.
Son el resultado de la proteolísis parcial de proteínas o con funciones biológicas importantes y diversas.
Nomenclatura:
- Nombres triviales
- Según su composición en aminoácidos
ENLACE PEPTÍDICO: FORMACIÓN DEL ENLACE PEPTÍDICO
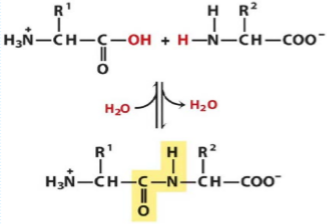
El grupo α-amino de un aminoácido (con el grupo R2) actúa como nucleófilo desplazando el grupo hidroxilo de otro aminoácido (con el grupo R1), para formar un enlace peptídico (sombreado en amarillo).
Los grupos amino son buenos nucleófilos, pero el grupo hidroxilo es un mal grupo saliente, por lo que no es desplazado facilmente.
A pH fisiológico, la reacción, que aquí se muestra no tiene lugar de manera apreciable.
Aunque la hidrólisis de un enlace peptídico es una reacción exergónica, tiene lugar lentamente debido a su alta energía de activación.
En consecuencia, los enlaces peptídicos de las proteínas son bastante estables, con una vida media de alrededor de 7 años en la mayoría de condiciones intracelulares.
CARACTERÍSTICAS DE LA ESTRUCTURA DEL ENLACE PÉPTIDICO
- Los seis átomos del grupo peptídico se encuentran en el mismo plano.
- El átomo de oxigeno del grupo carbonílicoy el átomo de hidrógeno del nitrógeno amídicose hallan entre ellos en posición trans.
- El oxigeno carbonílico y el nitrógeno amida comparten parcialmente dos pares de electrones. El enlace peptídico presenta híbridos de resonancia.
- El enlace peptídico presenta CARÁCTER PARCIAL DE DOBLE ENLACE.
- No hay rotación libre alrededor del enlace C-N.
- El oxigeno tiene una carga parcialnegativa y el nitrógeno una parcial positiva, formando un pequeño dipolo eléctrico.







